单细胞转录组技术能够在单个细胞水平上构建每个细胞的基因表达谱,反应细胞的异质性,有助于发现新的细胞类型,推动肿瘤相关研究的进展。随着研究的深入,研究者发现在病变组织中基因表达呈现空间模式,因此研究其空间异质性至关重要。
空间转录组技术将完整组织切片中细胞的基因表达数据与其所在的空间位置信息相结合,在识别不同细胞群的同时保留其原有的空间位置,进行一定分辨率的基因表达检测,从而理解细胞功能、表型和位置的关系,实现组织和生物体中基因表达的动态检测。
这两项技术各有优势也有相对缺陷,因此单细胞+空间技术的组合顺势而生,将两者的数据进行锚定和整合,既弥补了单细胞转录组无法展示的空间异质性,又解决了空间转录组的低分辨率问题。从多维角度揭示疾病发生发展过程中未知的生物学过程。
以今年发表在知名期刊Journal of Hepatology(IF=30.083)上的“Identification of a tumour immune barrier in the HCC microenvironment that determines the efficacy of immunotherapy ”文章为例,为大家介绍空间+单细胞多组学技术的联合应用揭示肿瘤微环境的案例。
01 研究目的
肝细胞癌(HCC)是肝癌中最常见的一种病理类型,预后相对较差,并且只有少数患者能够受益于免疫疗法(ICB)。本研究通过空间+单细胞多组学技术相结合,探究肿瘤微环境(TME)中的特征结构,为HCC的治疗提供新思路。
02 样本选择
空间转录组测序样本
8例接受抗PD-1治疗的肝癌患者的肿瘤切片(无应答者n=5;应答者n=3),相邻正常组织切片(n=3)。
单细胞转录组测序样本
6例肿瘤免疫治疗无反应患者中获得的肝癌肿瘤和邻近正常组织。
03 涉及技术
空间转录组,ScRNA-seq,多色免疫荧光分析。
04 实验设计
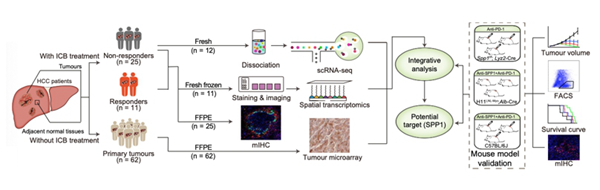
05 研究结果
空间转录组测序揭示了与免疫治疗效果相关的TIB微环境结构
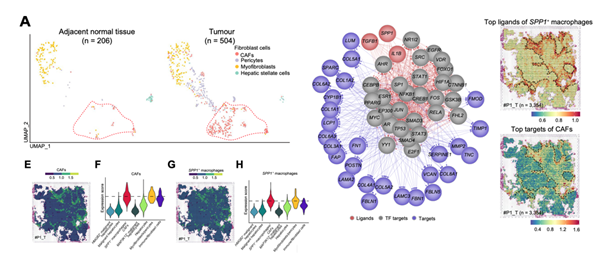
作者首先对样本进行了空间转录组测序,基于无监督聚类和spot特征,将肿瘤spots分为肝细胞、免疫/成纤维细胞、肌成纤维细胞/周细胞、SPP1+巨噬细胞/CAFs以及恶性肝细胞。由于CAFs和SPP1+巨噬细胞在同一点共定位多达10个细胞,因此无法区分,这表明这两种细胞类型之间存在物理相互作用。并且发现肿瘤细胞周围的SPP1+巨噬细胞/CAF簇在ICB非应答者中形成了TIB结构,但在应答者中却没有这种结构。
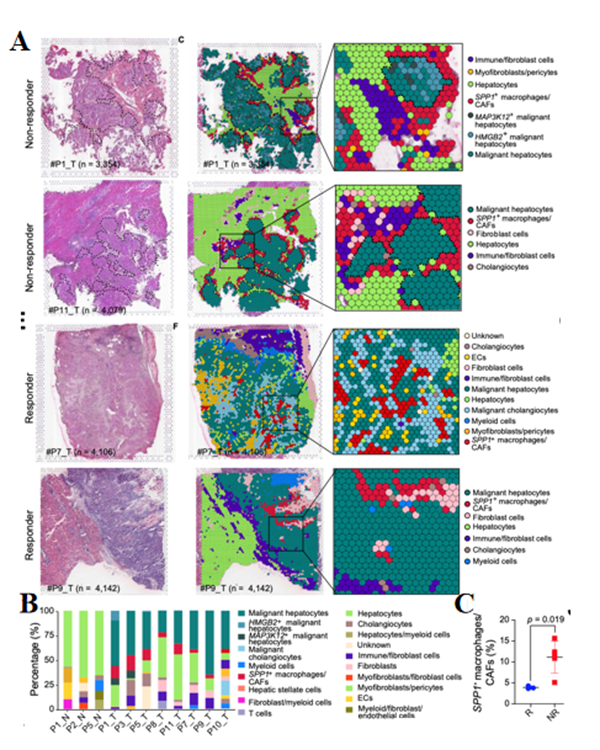
ICB不响应的肝癌患者癌和癌旁组织的单细胞转录图谱
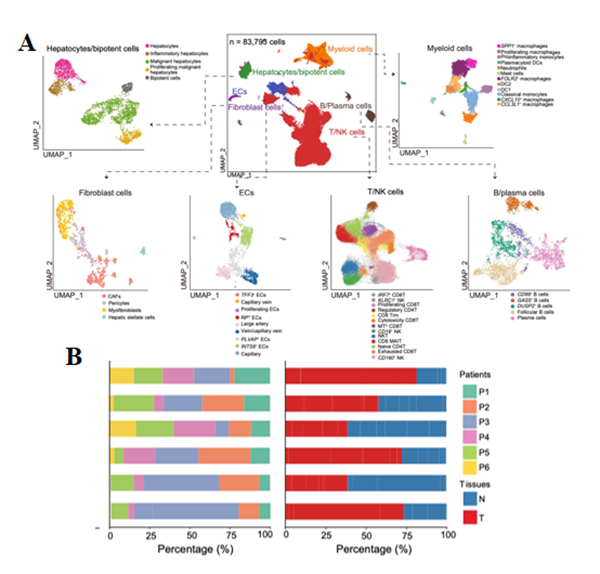
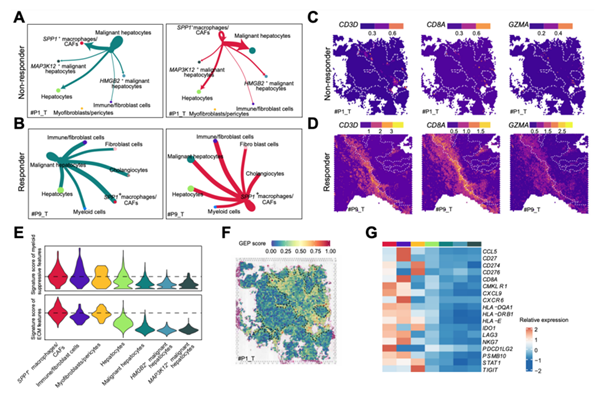
为了更好地了解TIB的细胞组成,作者对6例ICB无响应患者的肝癌肿瘤和相邻正常组织进行了scRNA-seq,获得了6种主要细胞类型包括T/NK细胞、髓系细胞、B/浆细胞、成纤维细胞、内皮细胞和肝细胞/双能细胞,并且发现髓系细胞和成纤维细胞的比例在肿瘤中显著增加。肿瘤和邻近正常组织之间浸润细胞类型的差异表明,TME的动态重构在无响应的HCC患者中起着重要作用。
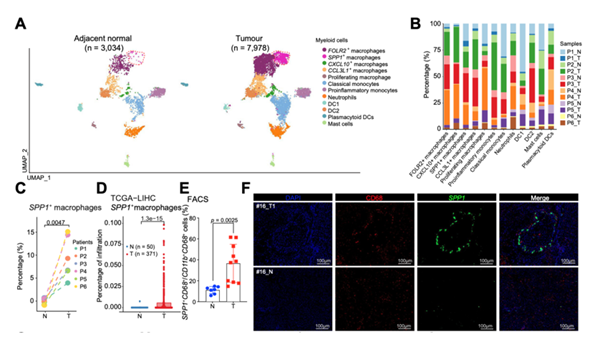
SPP1+巨噬细胞在肿瘤组织中显著富集
为进一步探索其中髓系细胞的异质性,作者基于ScRNA-seq的数据将临近正常组织和肿瘤中髓系细胞分为12个亚型,发现SPP1+巨噬细胞作为一个独立的亚型存在,并且其百分比在肿瘤中显著增加。流式分析显示,肿瘤组织中的SPP1+巨噬细胞浸润在无应答者中显著高于应答者;mIHC实验也证实了SPP1+巨噬细胞在HCC肿瘤中富集。
CAFs与SPP1+巨噬细胞的相互作用与TIB结构的形成有关
之后作者使用相同方法分析得到TIB中癌相关成纤维细胞(CAFs)的细胞分为四种亚型,比较了肿瘤组织和正常组织间的亚型差异,发现CAFs主要富集在肿瘤组织。通过整合scRNA-seq和空间转录组数据,发现SPP1+巨噬细胞和CAF在TIB结构中可能存在物理间相互作用,SPP1+巨噬细胞和CAFs中特异表达的基因共享一个ecm受体相互作用的通路,表明SPP1+巨噬细胞和CAFs的共定位可能与细胞迁移、粘附和ECM组织有关。SPP1+巨噬细胞和CAFs之间配体-靶点相互作用的靶基因极有可能属于细胞因子-细胞因子受体相互作用、ECM途径、TNF信号通路和IL-17信号通路。此外,从scRNA-seq数据中获得的SPP1+成纤维细胞前20个配体和CAFs前20个靶标的平均表达在SPP1+巨噬细胞/CAFs空间簇中高度富集,这些结果表明SPP1+巨噬细胞和CAFs紧密位于TIB中,并通过相关配体受体相互作用,促进TIB结构的形成。
TIB结构破坏恶性细胞和免疫细胞之间的相互作用,以限制对免疫治疗的反应
为了探索SPP1+巨噬细胞/CAFs在TIB中的潜在作用,作者评估了SPP1+巨噬细胞/CAFs和恶性肝细胞与其他空间细胞簇的相互作用权重。发现在ICB无应答者中,SPP1+巨噬细胞/ CAFs簇与恶性肝细胞的相互作用权重最强,但与免疫细胞的相互作用较弱;而在应答者中,SPP1+巨噬细胞/ CAFs、成纤维细胞和免疫细胞与HCC的相互作用权重相当,且在不具有TIB结构的ICB应答者中观察到免疫细胞浸润。mIHC染色显示SPP1+巨噬细胞倾向定位于肿瘤边界,而应答者肿瘤中SPP1+巨噬细胞浸润较少。这些结果表明SPP1+巨噬细胞相关的TIB结构的形成可能有助于HCC的免疫抑制微环境。
靶向SPP1破坏TIB结构,使HCC对免疫治疗敏感
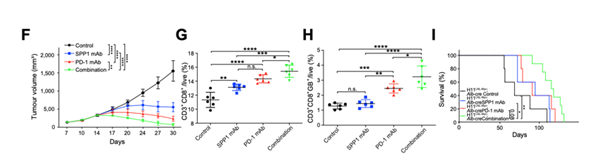
由于SPP1是一种分泌型糖磷蛋白,其表达与HCC的免疫抑制微环境密切相关,因此SPP1的缺失可以消除CAF对免疫微环境的抑制作用,从而使杀伤性T细胞渗入肿瘤核心。为了验证这个想法,作者建立SPP1选择性缺失的小鼠模型,在联合抗SPP1和抗PD-1治疗后,观察到肿瘤生长的减少,并显著提高了应答率,说明SPP1可能是预测需要免疫疗法的HCC患者预后有价值的生物标志物,阻断SPP1有助于提高抗PD-1免疫疗法的疗效。
06 总结
在本次研究中,作者通过空间+单细胞多组学技术相结合,确定了HCC TME中与免疫治疗疗效相关的TIB结构,揭示SPP1+巨噬细胞是一种潜在的HCC临床治疗靶点。阻断该靶点会破坏TIB结构,使HCC对免疫治疗敏感。


